? ? ? ?近日,南方科技大學生物醫學工程系副教授李凱課題組在《德國應用化學》(Angewandte?Chemie?International Edition,IF:12.257)發表題為“受體工程化調控光敏劑ROS生成誘導巨噬細胞向M1極化用于光動力免疫治療(Acceptor Engineering for Optimized ROS Generation Facilitates Reprogramming Macrophages to M1 Phenotype in Photodynamic Immunotherapy) ”的研究論文,并被遴選為“Hot Paper”。
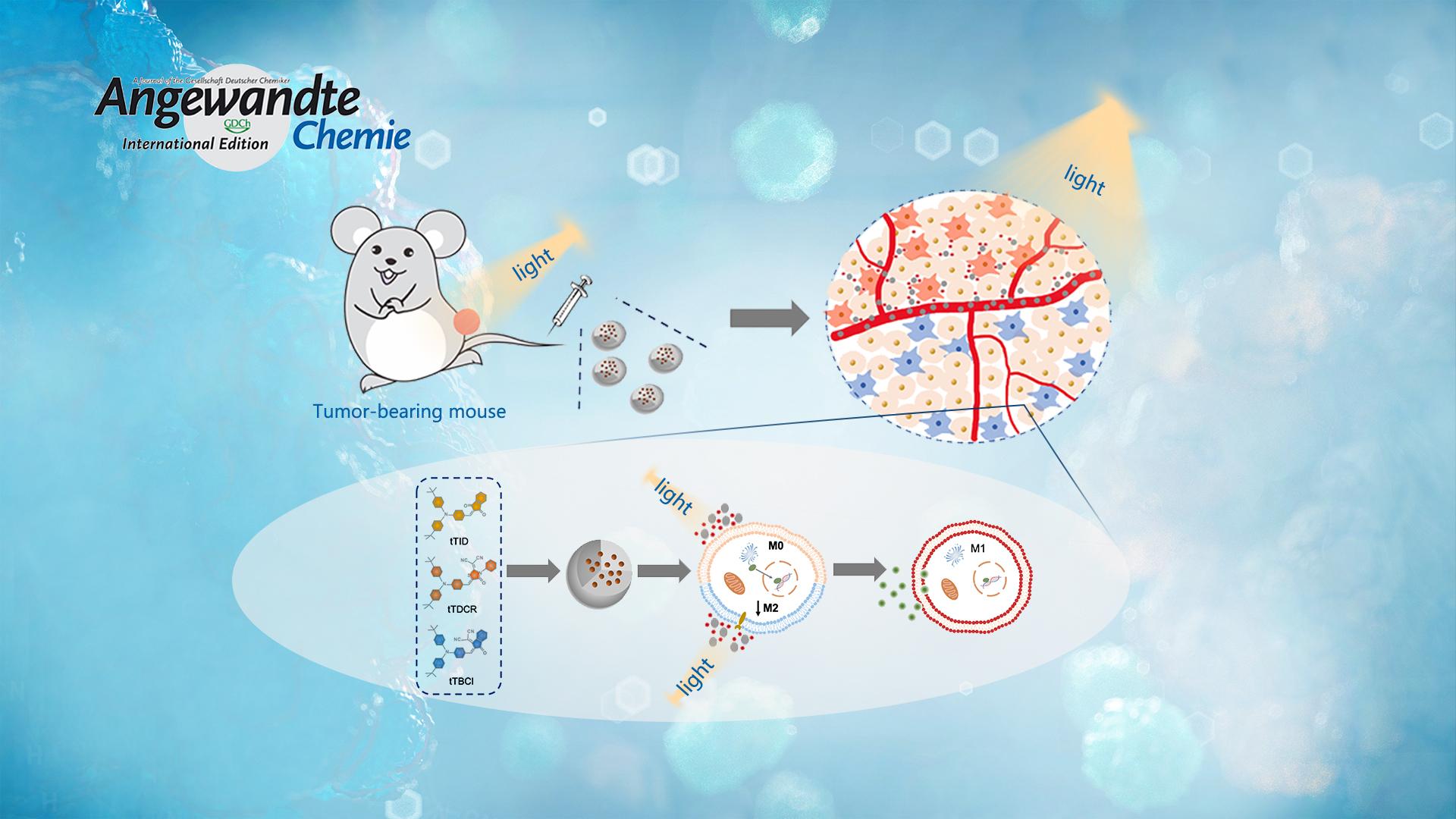
? ? ? ?腫瘤微環境的免疫抑制作用極大程度限制了現有的腫瘤免疫療法。而通過光動力治療(PDT)將腫瘤相關巨噬細胞(TAMs)重編程為抗腫瘤的M1表型是克服腫瘤微環境免疫抑制作用和促進腫瘤免疫治療的有效策略。然而,I型或II型PDT機制與TAMs極化效應之間的關系尚有待于進一步研究。為解答這一問題,李凱課題組通過改變D-A構型光敏劑的電子受體,實現對I型光敏劑ROS產率的調控。同時研究結果發現,該光敏劑主要通過I型PDT機制誘導TAMs極化,從而逆轉腫瘤微環境中的免疫抑制作用。
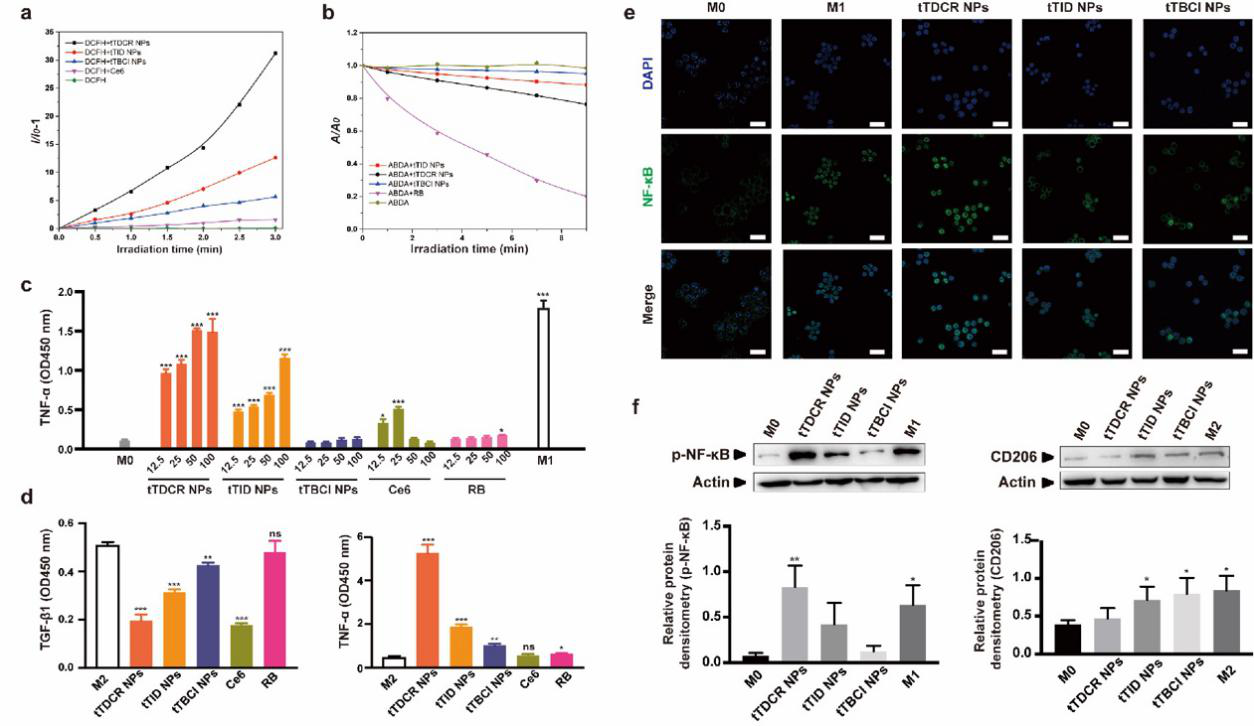
圖1. 光敏劑體外誘導巨噬細胞極化及其分子機制研究
? ? ? ?研究人員首先通過分子調控合成三種具有不同ROS產生效率的D-A構型的光敏劑tTBCI,tTID和tTDCR,其ROS產生效率依次升高,并具有聚集增強ROS產生的能力。實驗發現,I型機制產生的胞外ROS能夠將M0和M2型巨噬細胞誘導成M1型,并且具有最高ROS產生效率的分子tTDCR NPs效果最好,且這一作用是通過激活巨噬細胞內NF-κB信號通路實現的。而在相同實驗條件下,II型商業化光敏劑孟加拉紅(RB)產生的胞外ROS未顯示出誘導巨噬細胞向M1型極化的作用。

圖2. 光敏劑通過誘導腫瘤相關巨噬細胞極化抑制小鼠體內腫瘤生長
? ? ? ?體內實驗進一步證實,該I型光敏劑tTDCR NPs能夠通過誘導腫瘤組織內的M2型巨噬細胞極化為M1型,從而實現幾乎完全抑制小鼠4T1皮下瘤生長。而在清除腫瘤組織內的巨噬細胞后,tTDCR NPs抑制腫瘤生長的作用被逆轉。
? ? ? ?綜上所述,該I型光敏劑不僅可以逆轉腫瘤微環境的免疫抑制作用,還有望克服腫瘤部位缺氧的限制,無需借助其它免疫佐劑即可實現對缺氧腫瘤組織進行精準高效的PDT-免疫治療,具有巨大的應用潛力。同時,這一研究也為設計可激活巨噬細胞的新型光敏劑分子提供了參考,并為理解巨噬細胞活化在光動力免疫治療過程中的工作原理提供了新的見解。
? ? ? ?李凱課題組成員、博士后楊光為文章第一作者,李凱為通訊作者,南方科技大學為論文唯一通訊單位。該項研究獲得國家自然科學基金面上項目、廣東省引進創新創業團隊、深圳市科創委面上項目及高層次人才團隊等項目的資助。
論文鏈接:
https://onlinelibrary.wiley.com/doi/10.1002/anie.202013228
供稿:生物醫學工程系
文字:李凱 楊光
通訊員:肖然
主圖設計:丘妍
編輯:楊奐彥