? ? ? ?近日,南方科技大學生物醫學工程系張華威等科研人員在Nature?Communications雜志上以“Cryo-EM structure of human heptameric pannexin 2 channel”為題發表研究論文,報道泛連蛋白Pannexin?2 (Panx2)的冷凍電鏡結構及工作機制。
? ? ? ?泛連蛋白(Panx)可形成大孔非選擇性的膜通道,包括Panx1、Panx2及Panx3三類成員。Panx2可介導相鄰細胞之間或者細胞與細胞外基質之間的物質交換,轉運ATP及鈣離子等小分子,在細胞通訊和細胞穩態中發揮重要作用。Panx2的功能異常可導致缺血性腦損傷、神經膠質瘤和多形性膠質母細胞瘤等多種疾病。相對于Panx1及Panx3,Panx2 有著較長的序列和獨特的C端結構域,對Panx2的結構研究可為 Panx家族工作機制提供新見解。
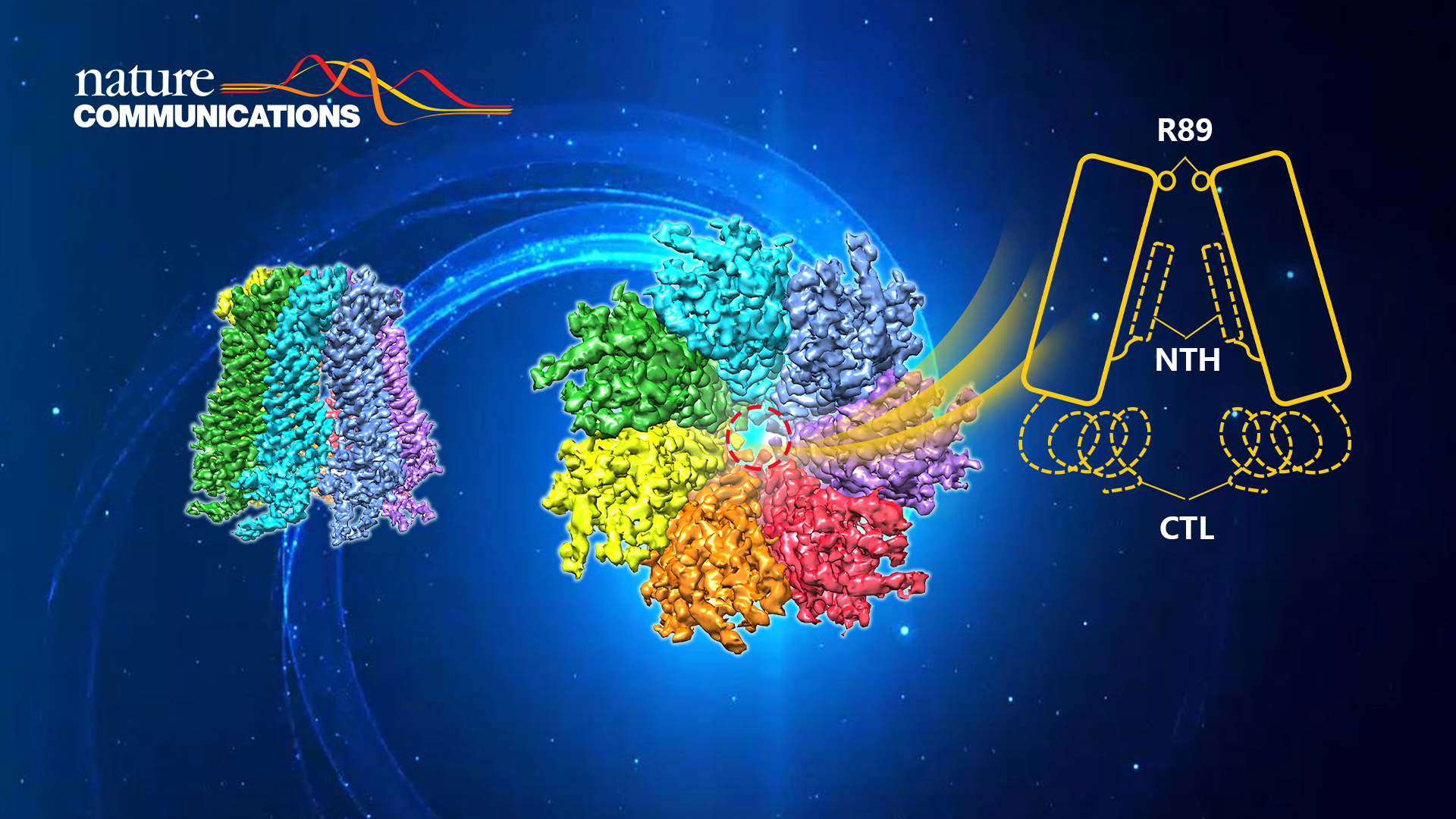
? ? ? ?在本項工作中,研究人員通過一系列表達條件及純化條件的篩選,得到適合冷凍電鏡研究的Panx2樣品,在南科大冷凍電鏡中心進行冷凍條件的篩選及數據收集工作,并最終獲得分辨率為3.4 ?的Panx2通道結構(圖1)。Panx2 由七個相同的亞基組成,它們圍繞跨膜通道以七重對稱的方式進行組裝。每個亞基可分為三個結構域:胞外結構域 (ECD)、跨膜結構域 (TMD) 和胞內結構域 (ICD)。其中胞外結構域中的Q91、E102、S264及Y94殘疾分別與相鄰亞基的Y82、Q285、Y82及S278殘疾形成相互作用位點,胞內結構域中的CH1 和?CH3螺旋分別與相鄰亞基的CH6 和?CH7螺旋相互作用,這些位點共同形成了Panx2七聚體的結構基礎。

圖1. Panx2冷凍電鏡結構
?
? ? ? ?通過Panx2與Panx1的結構比對分析、Panx2通道半徑分析以及Panx2通道靜電情況分析,研究人員推測本項目獲得的Panx2結構處于開放狀態。位于細胞外入口處的七個R89精氨酸殘基組成的環形成通道的最窄部位,作為調控底物選擇性的分子過濾器。這些觀察得到分子動力學模擬及ATP 釋放實驗的進一步驗證 (圖2)。本研究加深了人們對 Panx2 通道的認識,也為理解Panx家族的工作機制提供新的見解。

圖2.?R89殘基調控Panx2通道的開閉
? ? ? ?生物醫學工程系博士后張行博士為本文第一作者,張華威副研究員及中科院深圳先進技術研究院的袁曙光教授為本文通訊作者。南方科技大學為本文第一單位及通訊單位。本項目得到國家自然科學基金委員會、深圳市科技創新委員會、南方科技大學冷凍電鏡中心等單位在資金及技術方面的支持。
論文鏈接:https://www.nature.com/articles/s41467-023-36861-x