? ? ? ?近日,南方科技大學生物醫學工程系副教授李凱課題組在小分子光熱劑的機制研究及其在協同HSP70抑制策略的低溫光熱治療的應用取得最新進展。研究成果以“Photoinduced Nonadiabatic Decay-guided Molecular Motor Triggers Effective Photothermal Conversion for Hyperthermia Cancer Therapy”為題發表于化學類國際頂尖期刊《德國應用化學》(Angewandte Chemie International Edition)。

? ? ? ?光熱療法(PTT)已成為癌癥治療的重要研究方向,然而目前傳統的PTT面臨諸多局限,比如無機/有機光熱劑(photothermal agents, PTA)合成復雜、激光功率密度依賴較高、高溫PTT易造成正常組織損傷等副作用。因此,開發新型光熱劑介導的低溫(43℃)PTT策略具有重要意義。在本項工作中,課題組合理地設計出一種基于光誘導非絕熱衰退(PIND)效應的新型有機小分子,并利用Apoptozole(Apo)對細胞熱損傷修復蛋白HSP70的表達抑制作用,實現了808 nm激光器低功率密度下的43℃高效PTT腫瘤治療。
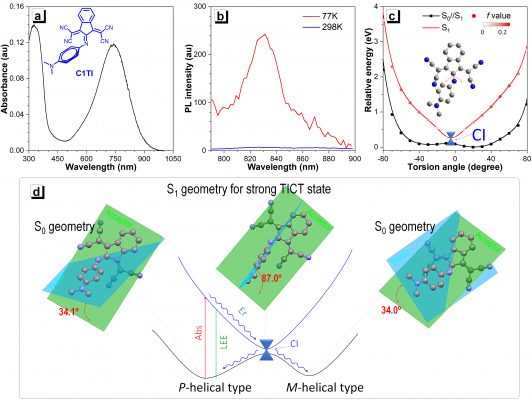
圖1.光誘導非絕熱衰退(PIND)型有機小分子的光物理性質及其工作原理。
? ? ? ?生物醫學工程系、前沿與交叉科學研究院研究副教授倪偵翔介紹,此次研制的新型有機小分子是一種亞胺基分子馬達,該類亞胺基分子馬達在受到激光照射而躍遷到激發態時,會受到較強的分子內扭曲電荷轉移(TICT)效應的影響,這種影響有助于其通過圓錐交叉(CI)過程,以非輻射衰退的方式釋放能量回到基態,而此過程可被視為一種光誘導非絕熱衰退(PIND)現象。相較于商業化探針ICG,該類激發態分子幾乎無熒光的釋放,因此能更完善地將光能轉換成熱能,實現高達90%的光熱轉換效率。
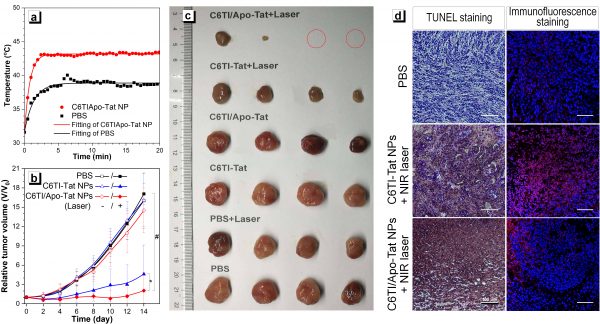
圖2. C6TI/Apo-Tat NPs介導的低溫PTT腫瘤治療。(a) 808nm激光器(0.5 W cm-2)照射小鼠腫瘤部位隨時間變化的溫度曲線圖;(b) 不同治療組腫瘤大小隨時間變化的腫瘤生長曲線;(c) 不同治療組第14天解剖所得腫瘤照片;(d) 原位腫瘤組織切片的HSP70免疫組化和TUNEL染色分析,標尺= 100?μm。
?
? ? ? ?在動物實驗方面,課題組通過納米沉淀法和細胞穿膜肽的表面修飾,構建出熱響應腫瘤細胞遞送系統,并且以裸鼠的4T1皮下移植瘤作為腫瘤模型,研究C6TI/Apo-Tat 納米微粒介導的低溫PTT腫瘤治療效果。如圖2a所示,小鼠尾靜脈注射C6TI/Apo-Tat 8小時后,使用808 nm激光器(0.5 W cm-2)照射小鼠,腫瘤部位快速升溫至43℃,并達到平臺期保持穩定。以此功率分別進行C6TI/Apo-Tat和C6TI-Tat介導的PTT腫瘤治療,結果顯示C6TI/Apo-Tat對腫瘤的治療效果顯著優于C6TI-Tat,且C6TI/Apo-Tat治療組腫瘤復發明顯低于C6TI-Tat治療組(圖2b、2c)。通過對兩個治療組原位腫瘤組織切片HSP70免疫和TUNEL組化染色分析(圖2d),課題組發現熱觸發釋放的Apo可有效抑制腫瘤部位細胞熱損傷修復蛋白HSP70的表達,導致C6TI/Apo-Tat介導的低溫PTT腫瘤細胞凋亡率顯著高于C6TI-Tat治療組,證明了該聯合治療策略的有效性。因此,本研究開發出新型高效光熱轉換分子馬達,避免了傳統光熱劑需要引用長烷基鏈或復雜取代基的合成方式,結合對熱損傷修復蛋白HSP70表達的抑制機理,有效突破了傳統高溫PTT治療的局限性,為小分子高效光熱劑的開發提供了新思路。
? ? ? ?南方科技大學為論文第一通訊單位,倪偵翔為論文第一作者,李凱為唯一通訊作者,課題組成員楊光、康天懌、查夢蕾、李迓曦等為共同作者。研究得到國家自然科學基金及深圳市基礎研究計劃等項目的資助。
論文鏈接:
https://www.onlinelibrary.wiley.com/doi/10.1002/anie.202002516
供稿:生物醫學工程系
通訊員:肖然
編輯:吳一敏
主圖設計:丘妍